【書類名】 明細書
【発明の名称】 熱三
【特許請求の範囲】
【請求項1】 熱は分子の周囲を回転している光子が排斥され抜け出した光子である。
【請求項2】 固体の分子の周囲には1分子の約10ー11倍の光子が回転している。液体の周囲には1分子の約2×10ー11倍の光子が回転している。気体の周囲には1分子の約3×10ー11倍の光子が回転している。これらの光子が分子の周囲から排斥されて、抜け出した光子が熱となる。
燃焼熱とは分子の周囲に付加し回転している光子が排斥された光子量である。
【請求項3】 更に詳しく、燃焼熱から1分子の周囲に付加している光子量を求める。その式は次のようである。
1分子の周囲に付加している光子量=1分子の光子量×10ー11×1分子の燃焼熱÷1分子の10ー11倍の光子量=1分子の燃焼熱
この計算により、炭素1分子の周囲に付加している光子量は1分子の約2.1×10ー11倍であり、水素1分子の周囲に付加している光子量は1分子の約8×10ー11 倍であり、気体の場合、分子の周囲に付加している光子量は1分子の約3.1〜3.6×10ー11倍である事が解る。
【請求項4】 発火点とは分子の周囲の光子が排斥するために必要なエネルギーの軌道の場を作るためのエネルギーである。発火点とは分子の周囲を回転している光子のうちで最も低エネルギーの軌道の光子(最も外側の軌道の光子)が抜け出すためのエネルギーの軌道の場を作るエネルギーである。
【請求項5】 熱は光子であり電磁波である。電磁波を発生させる1つの方法は発生させる光子のエネルギーの軌道より、それより大きなエネルギーの軌道の場を作り、分子、原子、電子、陽子の光子を排斥する事である。
【請求項6】 熱の伝達とは抜け出した光子が他のものに付加し、再び他のものの分子の周囲を回転する事である。
【発明の詳細な説明】
【0001】
【発明の属する技術分野】
本発明は、熱に関する。
【0002】
【従来の技術】
従来、熱は電子、陽子、中性子、原子、分子の運動によってできると考えられてきた。
【0003】
【発明が解決しようとする課題】
本発明は次の課題を解決しようとするものである。
1、 熱とは何か。熱の原理。
2、 熱はどうしてできるか。熱発生の原理。
3、 熱はどうして伝達されるか。熱の伝達原理。
【0004】
【課題を解決するための手段】
上記課題を解決するために、本発明者は平成14年7月7日に特許出願した『熱二』の【請求項4】及び、平成14年12月25日に特許出願した『元素ができた軌道エネルギーと電子、陽子、中性子に付加した光子の数とエネルギー』の【請求項4】を応用する。そして平成15年1月26日に提出した『電磁波』の発生原理に追加する。
【0005】
【発明の実施態様】
1、 熱とは何か。熱の原理。
平成14年7月7日に特許出願した『熱二』の【請求項4】に於いて、本発明者は、「液体とは固体に1分子の光子量の約10ー11倍の光子が付加し回転しているものである。気体とは液体に1分子の光子量の約10倍の光子が付加し回転しているものである」と記した。
この分子の周囲に付加し回転していた光子が排斥され抜け出した光子が熱である。
熱の原理は、熱とは電子、陽子、中性子、原子、分子を回転している光子が排斥され抜け出した光子である。
一般にガスコンロで使用する熱は分子の周囲を回転する光子が排斥され、抜け出した光子である。
燃焼熱とは1分子の周囲に付加し、回転している光子が排斥され、抜け出した光子量である。
A 例えば炭素(固体)の場合。
炭素(石墨)の燃焼熱は94.05Kcal/molです。
1分子の燃焼熱は、
94.05×103÷(6×1023)=15.675×10ー20(cal)
15.675×10ー20÷4.19≒3.74×10ー20(J) 3.74×10ー20Jです。
1分子の光子量は、
陽子の光子量は1.5×10ー10J
中性子の光子量は1.5×10ー10J
電子の光子量は8×10ー14Jですから、
6×(1.5×10ー10J+1.5×10ー10J+8×10−14J)≒18×10ー10J 18×10ー10Jです。
炭素は固体なので、分子の周囲に付加している光子量は1分子の約10ー11倍ですから、その光子量は、
18×10ー10J×10ー11=18×10ー21J=1.8×10ー20J
1.8×10ー20Jです。
炭素1分子の燃焼熱は3.74×10ー20Jであり、炭素1分子の周囲に付加し回転している光子量は1.8×10ー20Jです。
炭素1分子の燃焼熱は、炭素1分子の周囲に付加し回転している光子量の2.08倍です。
このことは、炭素1分子の周囲に付加し回転している光子量は1分子の光子量の2.08×10ー11 倍であると考えられます。
B エタノール(液体)の場合。
エタノールの燃焼熱は326.66Kcal/mol です。
エタノール1分子の燃焼熱は、
326.66×103÷(6×1023)≒54.44×10ー20(cal)
54.44×10÷4.19≒12.99×10ー20(J) 12.99×10ー20Jです。
エタノール(C2H5OH )1分子の光子量は、
Cが2個で、2×6×(1.5×10ー10J+1.5×10ー10J+8×10ー14J)≒36×10ー10J
Oが1個で、8×(1.5×10ー10J+1.5×10ー10J+8×10ー14J)≒24×10ー10J
Hが6個で、6×(1.5×10ー10J+8×10ー14J)≒9×10ー10J
合計で、69×10ー10Jです。
エタノールは液体なので、1分子の周囲に付加している光子量は1分子の光子量の約2×10−11倍ですから、その光子量は、
69×10ー10J×2×10ー11=13.8×10ー20J
13.8×10ー20Jです。
故に、エタノール1分子の周囲に付加し回転していた光子13.8×10ー20Jのうち12.99×10ー20Jが排斥し、熱となった。
C プロパン(気体)の場合。
プロパンの燃焼熱は530.60kcal/molです。
プロパン1分子の燃料熱は、
530.60×103÷(6×1023)≒88.43×10ー20 (cal)
88.43×10ー20÷4.19≒21.11×10ー20 (J) 21.11×10ー20Jです。
プロパン(C3H8)1分子の光子量は、
Cが3個で、3×6×(1.5×10ー10J+1.5×10ー10J+8×10ー14J)≒54×10ー10J
Hが8個で、8×(1.5×10ー10J+8×10ー14J)≒12×10ー10J
合計で、54×10ー10J+12×10ー10J=66×10ー10J
66×10ー10Jです。
プロパンは気体なので、1分子の周囲に付加している光子量は約3×10ー11倍ですから、その光子量は、
66×10ー10J×3×10ー11=19.8×10ー20J 19.8×10ー20Jです。
プロパン1分子の燃焼熱は21.11×10ー20Jで、1分子の周囲の光子量は19.8×10ー20Jです。
このことはプロパン1分子の周囲に付加し回転している光子量より1分子の燃焼熱の方がもっとエネルギーが多いという事です。
それでは1分子の燃焼熱と1分子の周囲に付加している光子量を比較してみます。
次に物質名と化学式、燃焼熱、1分子の燃焼熱、1分子の10−11倍の光子量、1分子の燃焼熱÷1分子の10−11 倍の光子量=倍数、を記します。(S)は固体、(L)は液体、(G)は気体です。
|
物質 |
化学式 |
燃焼熱 |
1分子の燃焼熱(単位は10ー20J) |
1分子の10ー11倍の光子量(単位は10ー20J) |
倍数 |
|
炭素(石墨) |
C(S) |
94.05 |
3.74 |
1.8 |
2.08 |
|
炭素(ダイアモンド) |
C(S) |
94.51 |
3.76 |
1.8 |
2.09 |
|
水素 |
H2(L) |
68.32 |
2.4 |
0.3 |
8 |
|
硫黄(斜方) |
S(S) |
70.96 |
2.82 |
4.8 |
0.59 |
|
ホルムアルデヒド |
HCHO(G) |
134.1 |
5.33 |
4.5 |
1.18 |
|
ギ酸 |
HCOOH(L) |
60.86 |
2.42 |
6.9 |
0.35 |
|
メタン |
CH4(G) |
212.80 |
8.46 |
2.4 |
3.53 |
|
メタノール |
CH3OH(L) |
173.6 |
6.91 |
4.8 |
1.44 |
|
二硫化炭素 |
CS2(L) |
402.7 |
16.02 |
11.4 |
1.41 |
|
アセチレン |
C2H2(G) |
310.62 |
12.36 |
3.9 |
3.17 |
|
シュウ酸 |
(COOH)2(S) |
52.23 |
2.08 |
12.3 |
0.17 |
|
エチレン |
C2H4(G) |
337.23 |
13.41 |
4.35 |
3.08 |
|
アセトアルデヒド |
CH3CHO(L) |
278.6 |
11.08 |
6.6 |
1.68 |
|
酢酸 |
CH3COOH(L) |
208.7 |
8.3 |
9.0 |
0.92 |
|
エタン |
CH3CH3(G) |
372.82 |
14.83 |
4.5 |
3.30 |
|
エタノール |
C2H5OH(L) |
326.66 |
12.99 |
6.9 |
1.88 |
|
ニトログリセリン |
C3H5(NO2)3(S) |
356.0 |
14.16 |
26.85 |
0.53 |
|
プロピレン |
C3H6(G) |
491.99 |
19.57 |
6.3 |
3.11 |
|
プロパン |
C3H8(G) |
530.60 |
21.11 |
6.6 |
3.20 |
|
グリセリン |
C3H8O3(L) |
397.4 |
15.81 |
13.8 |
1.15 |
|
n-ブタン |
C4H10(G) |
687.65 |
27.35 |
8.7 |
3.14 |
|
イソブタン |
C4H10(G) |
685.65 |
27.27 |
8.7 |
3.13 |
|
ベンゼン |
C6H6(L) |
780.98 |
31.07 |
12.0 |
2.59 |
|
フェノール |
C6H5OH(S) |
730.4 |
29.05 |
14.1 |
2.06 |
|
シクロヘキサン |
C6H12(L) |
841.0 |
33.45 |
12.6 |
2.65 |
|
n-ヘキサン |
C6H14(L) |
995.01 |
39.58 |
12.9 |
3.07 |
|
安息香酸 |
C6H5COOH(S) |
772.1 |
30.71 |
18.3 |
1.68 |
|
トルエン |
C6H5CH3(L) |
934.5 |
37.17 |
13.8 |
2.69 |
|
ナフタレン |
C10H8(S) |
1232.5 |
49.03 |
19.2 |
2.55 |
|
樟脳 |
C10H16O(S) |
1410.5 |
56.11 |
22.8 |
2.46 |
|
ショ糖 |
C12H22O11(S) |
1351.3 |
53.75 |
51.3 |
1.05 |
この表から次のことが理解できる。
1、炭素1分子に付加している光子の量は1分子の約2.1×10ー11倍である。
1、水素(液体)1分子に付加している光子の量は1分子の約8×10ー11倍である。
1、気体の場合、ホルムアルデヒドを除く他の物質の1分子の燃焼熱は1分子の10ー11倍の光子量の約3〜3.6である。
このことは、気体に付加している光子量は1分子の約3〜3.6×10ー11倍の光子量である事を証明している。
1、1分子の燃焼熱から1分子の周囲に付加している光子量が解かる。
1、1分子に付加している光子量=1分子の光子量×10ー11×倍数 =1分子の燃焼熱 である。
例えばショ糖の場合、ショ糖1分子の周囲に付加している光子量は
1分子の光子量×10ー11×倍数={12×6×(1.5×10ー10J+1.5×10ー10J+8×10ー14J)+22×(1.5×10ー10J+8×10ー14J)+11×8×(1.5×10ー10J+1.5×10ー10J+8×10ー14J)}×10ー11×1.05≒(216×10ー10J+33×10ー10J+264×10ー10J)×10ー11×1.05=53.865×10ー20J≒1分子の燃焼熱 である。
上記の式は、
倍数=1分子の燃焼熱÷1分子の10ー11 倍の光子量 であるから、
1分子の周囲に付加している光子量=1分子の光子量×10ー11×1分子の燃焼熱÷1分子の10ー11倍の光子量=1分子の燃焼熱
即ち、
1分子の周囲に付加している光子量=1分子の燃焼熱 である。
2、 熱はどうしてできるか。熱発生の原理。
平成14年12月25日に特許出願した『元素ができた軌道エネルギーと電子、陽子、中性子に付加した光子の数とエネルギー』の【請求項4】に於いて、本発明者は「エネルギー(光子)はどのようなメカニズムで発生するか。光子には自分のエネルギーと軌道がある。もし、そこの場の軌道が自分の軌道より小さかったら、自分の軌道が存在しない場であるなら、そこの場には光子は存在できない。それで光子は排斥される。この現象が光子の放出であり、光子(エネルギー)の発生です。」と記した。
熱もこれと同じメカニズム(原理)によって発生する。
即ち、分子の周囲の光子達は、自分のエネルギーに相当した軌道で回転している。しかし、自分達が存在する場の軌道エネルギーが自分達の軌道のエネルギーより高エネルギーの軌道の場に成った時、光子達はその場に存在できない。なぜなら、自分達のエネルギーの軌道はその場に無くなるからである。
その場の軌道のエネルギーが光子達の軌道のエネルギーより大きくなったとき、光子達は排斥され、その場を抜け出す。排斥され、抜け出した光子が熱である。
点火とは光子を排斥し、抜け出させる手段である。
点火によって高エネルギーの軌道の場を作り、分子の周囲に付加し回転しているそれより低エネルギーの軌道の光子を排斥させる。
分子の周囲に付加し回転している光子のうちで最も低エネルギーの軌道の光子より高エネルギーの軌道の場を作ることによって、低エネルギーの軌道の光子を排斥する。
このために点火する。
発火点とは、分子の周囲に付加し回転している最も低エネルギーの軌道の光子を排斥するため、高エネルギーの軌道の場を作るのに必要なエネルギーである。
混合気体の発火点は、
|
メタン |
CH4 |
800〜850度 |
|
エタン |
C2H6 |
540〜594度 |
|
プロパン |
C3H8 |
525〜588度 |
|
ペンタン |
C4H10 |
476〜548度 |
|
ヘキサン |
C5H12 |
300〜625度 |
|
ヘプタン |
C6H14 |
280〜580度 |
分子が小さいもの程発火点は高い。
この事は、小さな分子に付加している光子の軌道は小さくエネルギーは高いので、これらの光子を排斥するためには、もっと小さな高エネルギーの軌道の場を必要とするからです。小さな高エネルギーの軌道の場程高温である。
熱発生の原理は、その場にある光子の軌道エネルギーより高エネルギーの軌道の場を作り、高エネルギーの軌道の場で低エネルギーの軌道の光子を排斥させる事です。
一般に使用されているガスコンロの熱は高エネルギーの軌道の場を作るために、点火します。点火する事によって、高エネルギーの軌道の場ができ、分子の周囲に付加し回転している光子はそれより低エネルギーの軌道なので、排斥されます。
排斥し、抜け出した光子が熱です。
熱は光子であり電磁波です。
電磁波を発生させるためには、発生させる光子の軌道エネルギーより、もっと大きなエネルギーの軌道の場を作り、分子、電子、電子、陽子から次々に光子を排斥させる方法がある。
この電磁波の発生方法を平成15年1月26日に特許出願した電磁波の発生方法に追加する。
3、 熱はどうして伝達されるか。熱の伝達原理。
排斥し抜け出した光子は、次に、別のものの分子の周囲に付加し回転する。
熱の伝達原理は排斥し抜け出した光子が別の電子、陽子、中間子、原子、分子に付加し自分のエネルギーの軌道を回転することです。
ガスコンロの場合、排斥し抜け出した光子は鍋の構成分子に付加し、自分のエネルギーの軌道を回転する。又、他の排斥し抜け出した光子は水の分子に付加し、自分のエネルギーの軌道を回転する。
このことによって、光子を付加された分子はエネルギーが増加する。それで熱くなる。
【0006】
【発明の効果】
本発明によって次のことが解明された。
1 熱という光子である電磁波の発生は、より大きなエネルギーの軌道の場を作ることによって、分子、原子、電子、陽子から光子を排斥させることができる事を証明できた。
1 熱=光子=電磁波を発生させる1つの手段として点火する方法がある。これは発生させる光子のエネルギーの軌道より大きなエネルギーの軌道の場を作る方法である。
電磁波の発生方法としてこの方法を付け加える事ができた。
1 燃焼熱より、1分子の周囲に付加している光子量を正確に算出できた。
各々の分子の周囲には特定の光子量=燃焼熱分の光子量、が付加している事が解明できた。
1 1分子の燃焼熱=1分子の周囲に付加している光子量であることが理解できた。
1 熱の伝達は排斥された光子が他の分子に付加し回転することによってなされる。それで、熱効率が100%の場合、排斥された光子量と同じ光子量だけエネルギーは増える。これは、熱は振動によってできるのではない。熱は光子の移動によってできる証拠である。光子のエネルギーの移動である。
このことを、1分子の燃焼熱=1分子の周囲に付加している光子量(平成14年7月7日提出の特許出願事項)から推測した。そして今回は、より正確に燃焼熱から1分子に付加し回転している光子量が解明できた。
1 この発見によって、分子の周囲に光子が付加し回転していることが証明できた。
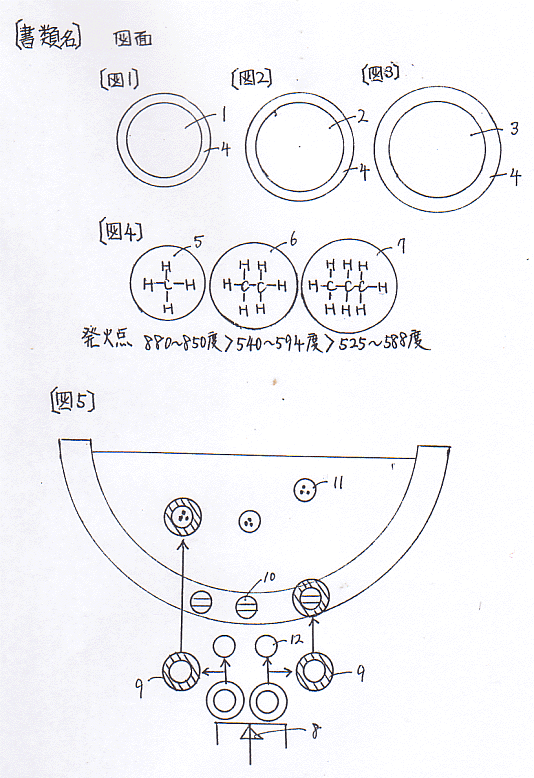
【図面の簡単な説明】
【図1】 炭素1分子の周囲に付加し回転している光子量。
【図2】 エタノール1分子の周囲に付加し回転している光子量。
【図3】 プロパン1分子の周囲に付加し回転している光子量。
【図4】 小さな分子程発火点は高い事を示す。
【図5】 点火により分子の周囲に付加している光子が排斥され、鍋や水の分子に付加し回転していることを示す図。
【符号の説明】
1 炭素分子 2 エタノール分子 3 プロパン分子
4 分子の周囲に付加している光子 5 メタン
6 エタン 7 ブタン 8 点火
9 排斥された光子 10 鍋の成分分子
11 水の分子 12 炭素と水素
【書類名】 要約書
【要約】
【課題】熱とは何か。熱の原理。熱はどのように発生するか。熱の発生原理。熱はどのように伝達されるか。熱の伝達原理。
【解決手段】本発明者が2002年7月7日に特許出願した『熱二』の【請求項4】において、「液体とは固体に1分子の光子量の約10ー11 倍の光子が付加し回転しているものである。気体とは液体に1分子の光子量の約10ー11倍の光子が付加し回転しているものである。」と記した。これらの光子が排斥したものが熱である。点火熱とは、光子を排斥するために、排斥する光子のエネルギーより大きなエネルギーの場を作るために必要なエネルギーである。気体の場合、1分子の周囲に付加している光子量が1分子の光子量の約3×10ー11 倍であり、これは1分子の燃焼熱にやや等しい事から分子の周囲に付加している光子が熱である事が理解できた。1分子の周囲に付加している光子量=1分子の燃焼熱である。
【選択図】図5