【書類名】 【明細書】
【発明の名称】 元素ができた軌道エネルギーと電子、陽子、中性子に付加した光子の数とエネルギー
【特許請求の範囲】
【請求項1】 ラブが公転し、ラブの周囲の光子が回転することによって、電磁力はできる。ラブは鉄芯、光子はコイルに流れる電子のように作用し、電磁力ができる。
【請求項2】 原子核にたくさんの陽子と中性子が存在でき、かつ原子核の大きさが一定であるのはどうしてか。
原子核の大きさの2分の1の大きさがラブの公転する軌道であるからです。ラブは原子核の2分の1の軌道を陽子、中性子、陽子、中性子と交互に並んで公転しています。それで、軌道の中にはどれだけたくさんのラブでも存在できます。ラブはとっても小さいのでたくさんのラブがその軌道に並べます。それで陽子の数と中性子の数は同じです。
【請求項3】 原子番号(原子量)の大きい元素ほど原子核でできる電磁力は大きい。
電磁力はラブの個数に比例します。そして、電磁力は光子の数に比例します。
それで、電磁力は原子番号の大きいほど大きいです。電磁力は原子量の大きいほど大きいです。
【請求項4】 エネルギー(光子)はどのようなメカニズムで発生するか。
光子には自分のエネルギーと軌道がある。もし、そこの場の軌道が自分の軌道より小さかったら、自分の軌道が存在しない場であるなら、その場には光子は存在できない。それで光子は排斥される。この現象が光子の放出であり、光子(エネルギー)の発生です。
【請求項5】 電子ニュートリノはどのようなメカニズムで発生するか。
電子の中で光子は回転している。太陽の中では、中央になるに従いエネルギーは高くなり軌道は小さくなる。軌道が小さくなると、その小さな軌道より大きな軌道の光子は居る場(軌道)が無くなるので放出する。太陽の核融合反応の行われる場(軌道)は電子ニュートリノの軌道より小さい。それで、電子ニュートリノは放出する。電子ニユートリノのエネルギーは5.1eVより小さい。5.1eVのエネルギーは5.1eV=5.1×1.6×10ー19J=8.16×10ー19J であり、軌道は1.1×10ー41J÷(8.16×10ー19J)=0.1348×10ー22m≒1.35×10ー23m です。電子ニュートリノの軌道は1.35×10ー23mより大きい。核融合反応の行われた軌道は1.35×10ー23mより小さい。それで、電子ニュートリノは居る場(軌道)が無いので放出する。
【請求項6】 太陽から放出されるエネルギー(光子)はどのような光子か。
太陽は中央になるに従いエネルギーが高くなり、軌道は小さくなる。エネルギーが高く軌道が小さい場では、それよりエネルギーが低く、軌道の大きな光子はそこに居る事はできない。それで放出する。この放出した光子が太陽からやってくる光子です。
【請求項7】 各々の元素ができる軌道とエネルギーはどれだけか。
元素はエネルギー密度を増してできる。初め、水素1.00794であった。それがエネルギー密度を増した。エネルギー密度は原子量÷1.00794です。
Heができた軌道は電子ニュートリノができた軌道です。
電子ニユートリノのエネルギーは0.51eVより小さいので、電子ニュートリノの軌道は、1.1×10ー41J÷(0.51×1.6×10ー19J)≒1.35×10ー23mより大きい。
電子ニユートリノができた軌道は1.35×10ー23mより小さい。
Heは1.35×10ー23mの軌道でできました。Heのエネルギー密度は4.002÷1.00794≒4 です。
エネルギー密度が4の元素は1.35×10ー23mの軌道でできる。
エネルギー密度がAである元素はどの軌道でできるか。
4÷A×1.35×10ー23m=5.4÷A×10ー23m の軌道でできる。
A=原子量÷1.00794 ですから、元素ができる軌道は
5.4÷(原子量÷1.00794)×10ー23m=5.44287÷原子量×10ー23m です。
原子量がBである元素は5.44287÷B×10ー23mの軌道でできます。
この軌道のエネルギーは1.1×10ー41J÷(5.44287÷B×10ー23m)=2.021×B×10ー19J です。
【請求項8】 各々の元素ができる軌道において、電子、陽子、中性子にどれだけの光子が付加されているか。
元素ができる軌道は電子の軌道です。元素ができる軌道の光子は電子に付加します。
電子に付加する光子のエネルギー=元素ができた軌道のエネルギー。
電子に付加する光子の数をC個とします。
陽子に付加する光子のエネルギーは、電子に付加する光子のエネルギーの(983+0.5)÷0.5=1877 倍です。
陽子に付加する光子の数を電子に付加する光子の数の3倍とします。
そうしますと、
電子のエネルギー=電子のラブのエネルギー+電子に付加する光子のエネルギー×C
陽子のエネルギー(=中性子のエネルギー)=陽子のラブのエネルギー+陽子に付加する光子のエネルギー×3C=陽子のラブのエネルギー+電子に付加する光子のエネルギー×1877×3C です。
電子のエネルギー+陽子のエネルギー+中性子のエネルギー=電子のラブのエネルギー+電子に付加する光子のエネルギー×C+2×(陽子のラブのエネルギー+陽子に付加する光子のエネルギー×3C)=8×10ー14J+2×1.5×10ー10J+元素ができた軌道のエネルギー×C+2×元素ができた軌道のエネルギー×1877×3C=3000.8×10ー13J+元素ができた軌道のエネルギー×11263×C=3000.8×10ー13J+2.021×B×10ー19J×11263×C=3000.8×10ー13J+22762.523×B×10ー19J×C
水素は1電子+1陽子で、0.5MeV+938MeV=938.5MeV=938.5×1.6×10ー13J=1501.6×10ー13J です。
水素は1501.6×10ー13Jで原子量は1.00794ですから原子量1は1501.6×10ー13J÷1.00794=1489.77×10ー13J です。
原子量×1489.77×10ー13J÷原子番号=電子のエネルギー+陽子のエネルギー+中性子のエネルギー=3000.8×10ー13J+22762.523×B×10ー19J×C
C=(原子量×1489.77×10ー13J÷原子番号−3000.8×10ー13J)÷(22762.523×原子量×10ー19J) です。
【請求項9】 請求項8で得たデーターから理解できる事は、
1.付加した光子の数はほとんど同じである。
2.付加した光子の総エネルギーは巨大星の中央ほど多くなっている。
3.原子番号の大きい元素ほど付加した光子のエネルギーは大きい。
4.これらの元素ができる軌道で付加した光子がラブの周囲を回転して電磁力を作っている。
5.元素ができる軌道において減少した光子はニュートリノとなる。電子から減少した光子は電子ニュートリノである。陽子から減少した光子は陽子ニュートリノ(本発明者が名づけた)である。即ち、Heの場合、Heができた軌道で、電子から1.36×10ー23mの軌道の光子が212個減少した。この減少した光子が電子ニュートリノである。電子ニュートリノは212個できた。陽子から7.24×10ー27mの軌道の光子が636個減少した。この減少した光子が陽子ニュートリノである。陽子ニュートリノは636個できた。
6.LiとBeに付加した光子エネルギーが多いのは、Heができた時に発生した光子が付加したからです。
7.ThとUが放射性元素であるのは元素ができた時多量の光子を付加したので、付加した光子を放散している。
8.各元素の電子の質量エネルギーは異なる。
9.各元素の陽子、中性子の質量エネルギーは異なる。
【請求項10】 電子の構造は中央にラブがあり、次に元素ができた軌道で付加した光子が回転し、次に連続X線が回転し、連続X線の範囲の中で特性X線が回転している。
【請求項11】 陽子の構造は中央にラブがあり、次に元素ができた陽子の軌道で付加した光子が回転し、その周囲を更に光子が回転している。
【発明の詳細な説明】
【0001】
【発明の属する技術分野】
本発明は素粒子に関する。
【0002】
【従来の技術】
従来、原子量は原子番号の大きい物程付加するエネルギーが多い。これは中性子が加わるためであると考えられている。太陽のエネルギーは核融合反応によってできると考えられている。電磁力の発生するメカニズムは解らない。
【0003】
【発明が解決鐘とする課題】
1、
電磁力はラブが自転し公転し、更に光子がラブの周囲を回転することによって発生する。ラブの周囲にはどれだけの光子が存在するのか。
2、
原子核の中にたくさんの陽子、中性子が存在できるのはどうしてか。
3、
原子核でできる電磁力と原子番号(原子量)の関係はどうなっているか。
4、
エネルギー(光子)はどのようなメカニズムで発生するか。
5、
電子ニュートリノはどのようなメカニズムで発生するか。
6、
太陽から光子はどのように放出するか。
7、
各々の元素ができた軌道とエネルギーはどのようであるか。
8、
元素ができる軌道において、どれだけの光子が付加されたか。
9、
8で得たデーターからどのような事が理解できるか。
10、 電子の構造はどのように成っているか。
11、 陽子の構造はどのようになっているか。
【0004】
【課題を解決するための手段】
上記課題を解決するために、本発明者は電子ニユートリノができる軌道をHeができる軌道とした。元素はエネルギー密度を高くすることによってできるので、初め水素で1.00794であった物が、次々電子、陽子、中性子が加わり、密度を増加させて元素はできたので、水素を基準にし、エネルギー密度を 原子量÷1.00794とした。陽子に付加した光子の数を電子に付加した光子の数の3倍とした。
【0005】
【発明の実施態様】
1、 電磁力はラブが自転し公転し、更に光子がラブを中心に回転することによってできる。即ち、ラブは鉄芯であり、光子はコイルの中を走る電子である。これで電磁力はできる。【図1】
2、 原子核の大きさはほぼ一定なのに、たくさんの陽子と光子が存在できるのはどうしてか。
原子核の大きさの2分の1がラブの公転軌道である。陽子のラブと中性子のラブは交互に並んでその軌道を公転している。ラブはとっても小さいものなのでいくらでも軌道の中に存在できる。100個でも200個でも存在できる。
それで、陽子の数と中性子の数は同じである。【図2】
3、 原子核でできる電磁力と原子番号(原子量)の関係はどのようであるか。
電磁力はラブの個数に比例し、光子の数に比例する。それで、電磁力は原子番号に比例し、原子量に比例する。
4、 エネルギー(光子)はどのように発生するか。
光子は自分の軌道を持つ。自分のエネルギーに合った軌道を持つ。もしその場の軌道が自分の軌道より小さかったら光子はそこに存在できない。自分の軌道が存在しないからです。それで光子はそこを逃げる。この現象が光子の放出であり、光子(エネルギー)の発生です。
5、 電子ニュートリノはどうして発生するか。
電子ニュートリノのエネルギーは5.1evより小さい。この軌道はどれ位か。
1.1×10ー41J÷(5.1×1.6×10ー19J)=1.348×10ー23m 約1.35×10ー23mです。
電子ニユートリノのエネルギーは5.1evより小さいのですから、軌道は1.35×10ー23mより大きい。軌道が1.35×10ー23mより小さな場(軌道)において、1.35×10ー23mより大きな軌道は存在しない。それで、電子ニュートリノは電子から放出する。【図3】
6、 太陽からの光子放出はどのようになっているか。
太陽は中央になるに従いエネルギーは高くなり軌道は小さくなる。
例えば太陽の外側で100万度の場合、そこの軌道は地球のエネルギーの1000000度÷25度=40000
4万倍です。電子の軌道は地球では10ー10mですから、太陽の外側では電子の軌道は10ー10m÷40000=2.5×10ー15m 2.5×10ー15mです。
それで、10ー10mから2.5×10ー15mまでの軌道を回転していた光子は放出します。
例えば太陽の中、1500万度の場の電子の軌道は10ー10m÷(15000000÷25)≒1.67×10ー16m 1.67×10ー16mです。
それで、電子のラブの周囲1.67×10ー16mまでの光子は放出します。
又、陽子のラブの周囲、1.67×10ー16m÷1877≒8.9×10ー20m
8.9×10ー20mまでの光子は放出します。【図4】
7、 各々の元素ができた場の軌道とエネルギーはどのようであるか。
5−1元素ができる場のエネルギー密度はどのようになっているか。
巨大星の中で元素はできます。巨大星の中央の場程エネルギー密度は高くなります。外側は水素です。水素のエネルギー密度を1とします。原子量1.00794で1です。巨大星の外側は1。中央になるに従ってエネルギー密度を増した。
元素のエネルギー密度は原子量÷1.00794です。
Heのエネルギー密度は4.0026÷1.00794≒3.97。Liは6.941÷1.00794≒6.89。Cは12.011÷1.00794≒11.9です。Uは238.0289÷1.00794≒236です。
5−2どの軌道でHeはできるか。
電子ニュートリノのできる場(軌道)でHeはできる。
5−3元素ができる軌道とエネルギー密度の関係。
Heはエネルギー密度が4.0026÷1.00794=3.97≒4で、この軌道で電子ニユートリノが発生する。Heができる軌道は1.35×10ー23mである。
エネルギー密度が4の軌道は1.35×10ー23mである。
即ち、エネルギー濃度がAである軌道は4÷A×1.35×10ー23m=5.4÷A×10ー23m です。A=原子量÷1.00794 ですから、5.4÷(原子量÷1.00794)×10ー23m=5.44287÷原子量×10ー23m です。
原子量がBである元素ができた軌道は5.44287÷B×10ー23mです。
この軌道のエネルギーは1.1×10ー41J÷(5.44287÷B×10ー23m)=2.021×B×10ー19J です。
8、 元素ができる軌道において、どれだけの光子が付加されたか。
8−1元素ができた軌道において、電子に付加する光子のエネルギーと陽子に付加する光子のエネルギーはどれだけか。
元素ができる軌道は電子ニュートリノから算出したので、この軌道は電子の軌道である。
陽子のエネルギーは電子のエネルギーの(938+0.5)÷0.5=1877 倍であり、軌道は1877分の1である。
電子に付加した光子の数をCとする。そして、陽子に付加した光子の数を電子に付加した数の3倍とする。
電子のエネルギー=電子のラブのエネルギー+元素ができる軌道で電子に付加した光子のエネルギー×C
陽子のエネルギー(=中性子のエネルギー)=陽子のラブのエネルギー+陽子に付加した光子のエネルギー×3C=陽子のラブのエネルギー+電子に付加した光子のエネルギー×1877×3C
電子のエネルギー+陽子のエネルギー+中性子のエネルギー=電子のラブのエネルギー+元素ができる軌道で電子に付加した光子のエネルギー×C+2×(陽子のラブのエネルギー+陽子に付加した光子のエネルギー×3×C)=8×10ー14J+2×1.5×10ー10J+元素ができた軌道のエネルギー×C+2×元素ができた軌道のエネルギー×1877×3×C=3000.8×10ー13J+元素ができた軌道のエネルギー×11263×C=3000.8×10ー13J+2.021×B×10ー19J×11263×C=3000.8×10ー13J+22762.523×B×10ー19J×C
8−2原子量1は何Jか。
水素は1電子1陽子であり原子量は1.00794です。これは何Jか。
0.5MeV+938MeV=938.5×1.6×10ー13J=1501.6×10ー13J
水素は原子量が1.00794で1501.6×10ー15Jですから、原子量1は1501.6×10ー13J÷1.00794=1489.77×10ー13J です。
電子のエネルギー+陽子のエネルギー+中性子のエネルギー=原子量×1489.77×10ー13J÷原子番号=3000.8×10ー13J+22762.523×B×10ー19J×C
C=(原子量×1489.77×10ー13J÷原子番号−3000.8×10ー13J)÷(22762.523×B×10Jー19)
電子の数=(原子量×1489.77×10ー13J÷原子番号−3000.8×10ー13J)÷(0.022762523×原子量×10ー13J)
まお、確かめ算は、原子量×1489.77×10ー13J=原子番号×(2×陽子に付加した光子の総エネルギー+電子に付加した光子の総エネルギー+3000.3×10ー13J) でできる。
上記の式から各元素の電子と陽子に付加した光子の数と付加したエネルギーと、電子、陽子のエネルギーを記す。
|
原子番号と記号 |
電子に付加した光子の数 |
元素ができた軌道エネルギー=電子に付加した光子のエネルギー |
電子に付加した光子の総エネルギー |
電子のエネルギー |
|
単位 |
個 |
10ー18J |
10ー18J |
8×10ー14J +10ー16J |
|
2 He |
−212 |
0.8089 |
−171.49 |
−1.7 |
|
3 Li |
2823 |
1.403 |
3960 |
39.6 |
|
4 Be |
1734 |
1.821 |
3157.6 |
31.58 |
|
5 B |
894 |
2.185 |
1953.4 |
19.53 |
|
6 C |
−67 |
2.427 |
−162.6 |
−1.63 |
|
7 N |
−62 |
2.831 |
−175.5 |
−1.76 |
|
8 O |
−58 |
3.233 |
−187.5 |
−1.88 |
|
9 F |
332 |
3.84 |
1274.9 |
12.75 |
|
10 Ne |
11 |
4.078 |
44.8 |
0.45 |
|
11 Na |
215 |
4.646 |
998.9 |
9.99 |
|
12 Mg |
30 |
4.912 |
147.4 |
1.47 |
|
13 Al |
148 |
5.453 |
807 |
8.07 |
|
14 Si |
−19 |
5.676 |
−107.8 |
−1.08 |
|
15 P |
107 |
6.260 |
669.8 |
6.7 |
|
16 S |
−21 |
6.470 |
−135.9 |
−1.36 |
|
17 Cl |
131 |
7.143 |
935.7 |
9.36 |
|
18 Ar |
335 |
8.088 |
2709.5 |
27.1 |
|
19 K |
72 |
7.914 |
569.8 |
5.7 |
|
20 Ca |
−16 |
8.088 |
−129.4 |
−1.29 |
|
21 Sc |
184 |
9.091 |
1672.7 |
16.73 |
|
22 Ti |
221 |
9.649 |
2132 |
21.32 |
|
23 V |
257 |
10.280 |
2642 |
26.42 |
|
24 Cr |
191 |
10.476 |
2001 |
20.01 |
|
25 Mn |
218 |
11.111 |
2422 |
24.22 |
|
26 Fe |
156 |
11.34 |
1769 |
17.69 |
|
27 Co |
187 |
11.911 |
2227 |
22.27 |
|
28 Ni |
91 |
11.861 |
1079 |
10.79 |
|
29 Cu |
182 |
12.843 |
2337 |
23.37 |
|
30 Zn |
165 |
13.221 |
2181 |
21.81 |
|
31 Ga |
220 |
14.085 |
3099 |
30.99 |
|
32 Ge |
228 |
14.667 |
3344 |
33.44 |
|
33 As |
223 |
15.152 |
3379 |
33.79 |
|
34 Se |
255 |
15.965 |
4071 |
40.71 |
|
35 Br |
220 |
16.153 |
3552 |
35.54 |
|
36 Kr |
244 |
16.949 |
4136 |
41.36 |
|
37 Rb |
226 |
17.268 |
3903 |
39.03 |
|
38 Sr |
217 |
17.713 |
3844 |
38.44 |
|
39 Y |
195 |
17.974 |
3505 |
35.05 |
|
40 Zr |
191 |
18.425 |
3519 |
35.19 |
|
41 Nb |
177 |
18.771 |
3322 |
33.22 |
|
42 Mo |
184 |
19.400 |
3570 |
35.70 |
|
43 Tc |
176 |
19.820 |
3488 |
34.88 |
|
44 Ru |
183 |
20.408 |
3735 |
37.35 |
|
45 Rh |
173 |
20.794 |
3597 |
35.97 |
|
46 Pd |
184 |
21.526 |
3961 |
39.61 |
|
47 Ag |
170 |
21.804 |
3707 |
37.07 |
|
48 Cd |
190 |
22.727 |
4318 |
43.18 |
|
49 In |
187 |
23.207 |
4340 |
43.40 |
|
50 Sn |
198 |
23.965 |
4745 |
47.45 |
|
51 Sb |
200 |
24.609 |
4922 |
49.22 |
|
52 Te |
225 |
25.761 |
5796 |
57.96 |
|
53 I |
196 |
25.641 |
5026 |
50.26 |
|
54 Xe |
207 |
26.506 |
5487 |
54.87 |
|
55 Cs |
198 |
26.829 |
5312 |
53.12 |
|
56 Ba |
208 |
27.777 |
5778 |
57.78 |
|
57 La |
199 |
28.061 |
5584 |
55.84 |
|
58 Ce |
187 |
28.351 |
5302 |
53.02 |
|
59 Pr |
173 |
28.497 |
4930 |
49.30 |
|
60 Nd |
176 |
29.178 |
5135 |
51.35 |
|
61 Pm |
163 |
29.333 |
4781 |
47.81 |
|
62 Sm |
178 |
30.387 |
5409 |
54.09 |
|
63 Eu |
171 |
30.726 |
5254 |
52.54 |
|
64 Gd |
184 |
31.792 |
5850 |
58.50 |
|
65 Tb |
177 |
32.164 |
5693 |
56.93 |
|
66 Dy |
180 |
32.836 |
5910 |
59.10 |
|
67 Ho |
177 |
33.333 |
5900 |
59.00 |
|
68 Er |
174 |
33.846 |
5889 |
58.89 |
|
69 Tm |
168 |
34.161 |
5739 |
57.39 |
|
70 Yb |
173 |
34.921 |
6041 |
60.41 |
|
71 Lu |
168 |
35.370 |
5942 |
59.42 |
|
72 Hf |
170 |
36.066 |
6131 |
61.31 |
|
73 Ta |
167 |
36.545 |
6103 |
61.03 |
|
74 W |
167 |
37.162 |
6206 |
62.06 |
|
75 Re |
164 |
37.671 |
6178 |
61.78 |
|
76 Os |
168 |
38.462 |
6462 |
64.62 |
|
77 Ir |
164 |
38.869 |
6375 |
63.75 |
|
78 Pt |
163 |
39.427 |
6427 |
64.27 |
|
79 Au |
159 |
39.855 |
6337 |
63.37 |
|
80 Hg |
160 |
40.590 |
6494 |
64.94 |
|
81 Ti |
162 |
41.353 |
6699 |
66.99 |
|
82 Pb |
161 |
41.825 |
6734 |
67.34 |
|
83 Bi |
157 |
42.308 |
6642 |
66.42 |
|
90 Th |
727 |
46.809 |
34030 |
340.30 |
|
92 U |
711 |
48.035 |
34153 |
341.53 |
|
原子番号と記号 |
陽子に付加した光子の数=電子に付加した光子の数×3 |
陽子に付加した光子のエネルギー=電子に付加したエネルギー×1877 |
陽子に付加した光子の総エネルギー=光子のエネルギー×光子の数 |
陽子の質量エネルギー |
|
単位 |
個 |
10ー15J |
10ー15J |
1.5×10-10J +10ー12J |
|
2 He |
−636 |
1.529 |
−972.444 |
−0.972444 |
|
3 Li |
8469 |
2.633 |
22298.877 |
22.298877 |
|
4 Be |
5202 |
3.418 |
17780.436 |
17.780436 |
|
5 B |
2682 |
4.105 |
11009.61 |
11.00961 |
|
6 C |
−201 |
4.557 |
−915.957 |
−0.915957 |
|
7 N |
−186 |
5.308 |
−987.288 |
−0.987288 |
|
8 O |
−168 |
6.072 |
−1020.096 |
−1.020096 |
|
9 F |
996 |
7.218 |
7189.128 |
7.189128 |
|
10 Ne |
33 |
7.647 |
252.351 |
0.252351 |
|
11 Na |
645 |
8.711 |
5618.595 |
5.618595 |
|
12 Mg |
90 |
9.218 |
829.62 |
0.82962 |
|
13 Al |
444 |
10.222 |
4538.568 |
4.538568 |
|
14 Si |
−57 |
10.643 |
−606.651 |
0.606651 |
|
15 P |
321 |
11.731 |
3765.651 |
3.765651 |
|
16 S |
−63 |
12.144 |
−765.072 |
−0.765072 |
|
17 Cl |
393 |
13.407 |
5268.951 |
5.268951 |
|
18 Ar |
1005 |
15.181 |
15256.905 |
15.256905 |
|
19 K |
216 |
14.855 |
3208.68 |
3.20868 |
|
20 Ca |
−48 |
15.181 |
−728.688 |
−0.728688 |
|
21 Sc |
552 |
17.064 |
9419.328 |
9.419328 |
|
22 Ti |
663 |
18.111 |
12007.593 |
12.007593 |
|
23 V |
771 |
19.3 |
14880.3 |
14.8803 |
|
24 Cr |
573 |
19.663 |
11266.899 |
11.266899 |
|
25 Mn |
654 |
20.855 |
13639.17 |
13.63917 |
|
26 Fe |
468 |
21.285 |
9961.38 |
9.96138 |
|
27 Co |
561 |
22.357 |
12542.277 |
12.542277 |
|
28 Ni |
273 |
22.263 |
6077.799 |
6.077799 |
|
29 Cu |
546 |
24.106 |
13161.876 |
13.161876 |
|
30 Zn |
495 |
24.816 |
12283.92 |
12.28392 |
|
31 Ca |
660 |
26.438 |
17449.08 |
17.44908 |
|
32 Ge |
684 |
27.530 |
18830.52 |
18.83052 |
|
33 As |
669 |
28.440 |
19026.36 |
19.02636 |
|
34 Se |
765 |
29.966 |
22923.99 |
22.92399 |
|
35 Br |
660 |
30.319 |
20010.54 |
20.01054 |
|
36 Kr |
732 |
31.813 |
23287.116 |
23.287116 |
|
37 Rb |
678 |
32.412 |
21975.336 |
21.975336 |
|
38 Sr |
651 |
33.247 |
21643.797 |
21.643797 |
|
39 Y |
585 |
33.737 |
19736.145 |
19.736145 |
|
40 Zr |
573 |
34.584 |
19816.632 |
19.816632 |
|
41 Nb |
531 |
35.233 |
18708.723 |
18.708723 |
|
42 Mo |
552 |
36.414 |
20100.528 |
20.100528 |
|
43 Tc |
528 |
37.202 |
19642.656 |
19.642656 |
|
44 Ru |
549 |
38.306 |
21029.994 |
21.029994 |
|
45 Rh |
519 |
39.030 |
20256.57 |
20.25657 |
|
46 Pd |
552 |
40.404 |
22303.008 |
22.303008 |
|
47 Ag |
510 |
40.926 |
20872.26 |
20.87226 |
|
48 Cd |
570 |
42.659 |
24315.63 |
24.31563 |
|
49 In |
561 |
43.560 |
24437.16 |
24.43716 |
|
50 Sn |
594 |
44.982 |
26719.308 |
26.719308 |
|
51 Sb |
600 |
46.191 |
27714.6 |
27.7146 |
|
52 Te |
675 |
48.353 |
32638.275 |
32.638275 |
|
53 I |
588 |
48.128 |
28299.264 |
28.299264 |
|
54 Xe |
621 |
49.752 |
30895.992 |
30.895992 |
|
55 Cs |
594 |
50.358 |
29912.652 |
29.912652 |
|
56 Ba |
624 |
52.137 |
32533.488 |
32.533488 |
|
57 La |
597 |
52.671 |
31444.587 |
31.444587 |
|
58 Ce |
561 |
53.215 |
29853.615 |
29.853615 |
|
59 Pr |
519 |
53.489 |
27760.791 |
27.760791 |
|
60 Nd |
528 |
54.767 |
28916.976 |
28.916976 |
|
61 Pm |
489 |
55.058 |
26923.362 |
26.923362 |
|
62 Sm |
534 |
57.036 |
30457.224 |
30.457224 |
|
63 Eu |
513 |
57.673 |
29586.249 |
29.586249 |
|
64 Gd |
552 |
59.674 |
32940.048 |
32.940048 |
|
65 Tb |
531 |
60.372 |
32057.532 |
32.057532 |
|
66 Dy |
540 |
61.633 |
33281.82 |
33.28182 |
|
67 Ho |
531 |
62.566 |
33222.546 |
33.222546 |
|
68 Er |
522 |
63.529 |
33162.138 |
33.162138 |
|
69 Tm |
504 |
64.120 |
32316.48 |
32.31648 |
|
70 Yb |
519 |
65.547 |
34018.893 |
34.018893 |
|
71 Lu |
504 |
66.390 |
33460.56 |
33.46056 |
|
72 Hf |
510 |
67.696 |
34.52496 |
34.52496 |
|
73 Ta |
501 |
68.595 |
34366.095 |
34.366095 |
|
74 W |
501 |
69.753 |
34946.253 |
34.946253 |
|
75 Re |
492 |
70.709 |
34788.828 |
34.788828 |
|
76 Os |
504 |
72.193 |
36385.272 |
36.385272 |
|
77 Ir |
492 |
72.957 |
35894.844 |
35.894844 |
|
78 Pt |
489 |
74.005 |
36188.445 |
36.188445 |
|
79 Au |
477 |
74.808 |
35683.416 |
35.683416 |
|
80 Hg |
480 |
76.187 |
36569.76 |
36.56976 |
|
81 Ti |
486 |
77.620 |
37723.32 |
37.72332 |
|
82 Pb |
483 |
78.506 |
37918.398 |
37.918398 |
|
83 Bi |
471 |
79.412 |
37403.052 |
37.403052 |
|
90 Th |
2181 |
87.861 |
191624.841 |
191.624841 |
|
92 U |
2133 |
90.162 |
192315.546 |
192.315546 |
9、8で得たデーターからどのような事が理解でこるか。
1. 付加した光子の数はほとんど同じである。
2. 付加した光子の総エネルギーは巨大星の中ほど多くなっている。
3. 原子番号の大きい元素ほど付加した光子のエネルギーは大きい。
4. これらの元素ができる軌道で付加した光子がラブの周囲を回転して電磁力を作っている。
5. 元素ができる軌道において、減少した光子はニュートリノとなる。
電子から減少した光子は電子ニュートリノである。
陽子から減少した光子は陽子ニュートリノ(本発明者が付けた名前)である。即ち、Heの場合、Heができた軌道で、電子から1.36×10ー23mの光子が212個減少した。この減少した光子が電子ニュートリノである。電子ニュートリノは212個できた。
陽子から7.24×10ー27mの軌道の光子が636個減少した。この減少した光子が陽子ニュートリノである。陽子ニュートリノは636個できた。
6. LiとBeに付加した光子エネルギーが多いのはHeができた時発生した光子が付加したからです。
7. ThとUが放射性元素であるのは元素ができた時、多量の光子を付加したので、付加した光子を放散している。
8. 各元素の電子の質量エネルギーは異なる。
9. 各元素の陽子と中性子の質量エネルギーは異なる。
10、電子の構造はどのようになっているか。
電子の構造は中央にラブ、次に元素ができた軌道で付加した光子が回転し、次に連続X線が回転し、連続X線の範囲内で特性X線が回転している。一例として鉄のM殻を回転している電子を図示する。【図6】
11、陽子の構造はどのように成っているか。
陽子の構造は中央にラブ、次に元素ができた陽子の軌道で付加した光子が回転し、その周囲を更に光子が回転している。一例として鉄の陽子を図示する。【図7】
【0006】
【発明の効果】
この発明によって、電子、陽子、中性子は、元素ができた軌道の光子を付加したことを理解できた。ラブのエネルギーは一定であるが、付加した光子量によって、原子量はまちまちである。LiとBeの電子、陽子、中性子のエネルギーが高いのはHeができた時発生した光子が多量に付加したためであると理解できた。Th、Uが放射性元素であるのは余りに多量の光子が付加したため、その光子を徐々に放出しているのであると理解できた。電子のラブは自転しかつ公転し、ラブの周囲にたくさんの光子が付加し回転しているので、電磁力ができると理解できた。陽子のラブは自転し、かつ公転し、ラブの周囲にたくさんの光子が付加し回転しているので、電磁力ができると理解できた。各々の元素の電子のエネルギーは異なる事が理解できた。各々の元素の陽子のエネルギー、中性子のエネルギーは異なる事が理解できた。
【図面の簡単な説明】
【図1】 ラブは鉄芯、光子はコイルを流れる電子のように回転し電磁力ができる。
【図2】ラブの軌道は原子核の2分の1で、陽子のラブと中性子のラブは交互に並んで公転している。
【図3】 電子ニュートリノが発生するメカニズム。
【図4】 太陽の中で光子が発生するメカニズム。
【図5】 エネルギー密度と元素ができた軌道と付加(減少)した光子の数。
Heの場合と鉄の場合。
【図6】 鉄の電子の構造。
【図7】 鉄の陽子の構造
【符号の説明】
1 ラブ 2 ラブの軌道 3 光子 4 陽子のラブ
5 中性子のラブ 6 原子核 7 電子のラブ
8 電子ニュートリノの軌道 9 電子ニュートリノより小さな軌道
10 電子
11 Heの電子ができた軌道 12 Heの陽子ができた軌道
13 鉄の電子ができた軌道 14 鉄の陽子ができた軌道
15 連続X線 16 特性X線Kβ 17 特性X線Kα2
18 特性X線Kα1 19 陽子のラブの周囲の光子
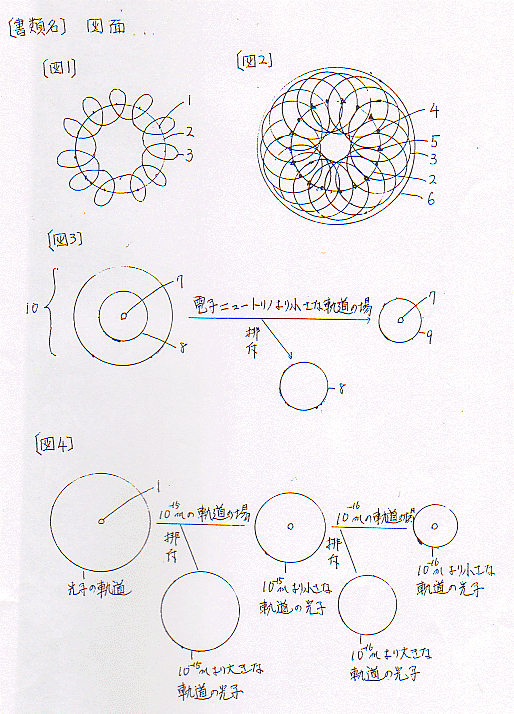

【書類名】 要約書
【要約】
【課題】 電磁力はラブが自転し更に公転しその周囲を光子が回転することによってできる。各元素においてどれだけの光子が回転しているか。放射性元素はどうして光子を放射するのか。
【解決手段】 電子ニュートリノはHeができた場で発生する。そのメカニズムを考え、太陽の中で光子はどのように放出するか考えた。原子はエネルギー密度を高くすることによってできる。Heのエネルギー密度は約4である。Heの電子ができた軌道は電子ニュートリノができた軌道である。これで、元素のエネルギー密度と元素ができた軌道の関係がわかる。そして原子量から元素ができた軌道の光子がどれだけ付加したかが解る。この付加した光子がラブの周囲を回転することによって電磁力はできる。各元素の電子の質量エネルギーは異なる。各元素の陽子と中性子の質量エネルギーは異なる。
【選択図】 図5